
订购NovaSeq X系列
将先进的化学、光学和信息学技术相结合,实现了超凡的速度和数据质量、出色的通量和可扩展性。
FDA批准、CE认证的体外诊断(IVD)新一代测序检测可在一种产品中方便地进行两次囊性纤维化检测。
此产品仅在某些选定区域可用。请选择 您希望发货的目的地 ,查看该产品是否在该区域可用。
MiSeqDx Reagent Kit v3, Micro为24-36个样本的较小批量运行提供了一种灵活、经济的选择。该产品目前已通过TruSight Cystic Fibrosis 139-Variant Assay的独家使用验证。在特定地区提供。
TruSight Cystic Fibrosis是FDA批准的体外诊断(IVD)NGS解决方案,将两种囊性纤维化检测整合到一个工作流程中。
准确检测截至2013年8月CFTRCFTR2变异。1
捕获蛋白质编码区和内含子/外显子边界中的所有变异,获得CFTR基因的完整视图。
| Method | Targeted DNA Sequencing, Amplicon Sequencing |
|---|---|
| 分析时间 | 2.5天 |
| 手动操作时间 | 3.5小时 |
| 技术 | Illumina测序 |
| 样本通量 | 每次测序运行24–96个样本 |
| 核酸类型 | DNA |
| 物种 | 人 |
| 系统 | MiSeqDx |
| 起始量 | 250 ng基因组DNA |
可选产品:
TruSight Cystic Fibrosis是一种经FDA批准、CE认证的IVD NGS检测,提供两种囊性纤维化检测,用于携带者筛查、新生儿和儿童的确认诊断检测、辅助诊断的初步检测(TruSight Cystic Fibrosis 139-Variant检测),以及非典型表现或其他panel未能识别致病突变的检测(TruSight Cystic Fibrosis Clinical Sequencing Assay)。
TruSight Cystic Fibrosis 139-Variant Assay
TruSight Cystic Fibrosis Clinical Sequencing Assay
MiSeqDx Reagent Kit v3,Micro
分子诊断,分子检测,基因组学诊断仪器_Illumina中国官网
Illumina为临床实验室提供了基于新一代测序的分子诊断方案。
美国FDA批准的新一代测序panel,用于检测囊性纤维化的致病性变异和临床相关变异。
通过定向重测序,可以将一个基因子集或基因组区域分离出来并进行测序,从而节省实验室资源。
TruSight Cystic Fibrosis 139-Variant Assay
Illumina TruSight Cystic Fibrosis 139-Variant Assay是一种定性体外诊断系统,用于同时检测从人类外周全血样本中分离的基因组DNA中囊胞性纤维症跨膜传导调节因子(CFTR)基因的139个临床相关囊胞性纤维症致病突变和变异。这些变异包括2004年美国医学遗传学会(ACMG)4和2011年美国妇产科医师学会(ACOG)推荐的变异。5
该测试用于在育龄成人中进行携带者筛查、在新生儿和儿童中进行确认性诊断测试,并且作为初始测试帮助诊断怀疑罹患囊性纤维化的个体。该测试的结果将由委员会认证的临床分子遗传学家或等同者解析,并且应结合其他可用的实验室和临床信息使用。该测试不适用于新生儿筛查、胎儿诊断测试、移植前检测或单独诊断目的。
此测试适于在Illumina MiSeqDx仪器上执行。
TruSight Cystic Fibrosis Clinical Sequencing Assay
Illumina TruSight Cystic Fibrosis Clinical Sequencing Assay是一种靶向测序体外诊断系统,可对从K2EDTA中采集的人类外周全血样本中分离的基因组DNA中的囊性纤维化跨膜传导调节因子(CFTR)基因的蛋白质编码区和内含子/外显子边界进行重新测序。该测试将检测所测序区域内的单核苷酸位点变异和小插入缺失,还会报告两个深内含子突变和两个大缺失。此测试适于在Illumina MiSeqDx仪器上执行。
此测试用作诊断怀疑罹患囊性纤维化(CF)的个体的辅助手段。该测试最适于具有非典型CF症状或者其他突变panel不能鉴定诱发性突变的患者。该测试结果将由委员会认证的临床分子遗传学家或等同者解析,并且应结合其他可用信息使用,包括临床症状、其他诊断测试和家族病史。此测试不适于单独诊断目的、胎儿诊断测试、移植前测试、携带者筛查、新生儿筛查或群体筛查。
供体外诊断使用
联系因美纳代表获取该地区是否上市的信息。
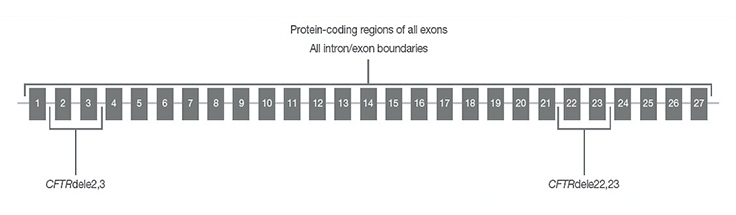

使用TruSight Cystic Fibrosis Clinical Sequencing Assay对CFTR区域进行测序
通过该检测测序的CFTR区域包括所有外显子的蛋白质编码区域、内含子/外显子边界、5'和3' UTR的约100 nt侧翼序列、两个深度内含子突变(1811+1.6 kbA>G、3489+10 kbC>T)、两个大缺失(CFTRdele2、3、CFTRdele22、23)和PolyTG/PolyT区域。
TruSight Cystic Fibrosis 139-Variant Assay的临床相关CFTR变异
TruSight Cystic Fibrosis 139-Variant Assay可检测139个临床相关CFTR变异1
| ACMG-23列表中用于CF筛查的突变 | ||
| R347P | 1717-1G >A | 3849+10 kbC>T |
| G85E | G542X | W1282X |
| R117H | G551D | 711+1G>T |
| 621+1G>T | R553X | R560T |
| R334W | 2184delA | 1898+1G>A |
| A455E | 2789+5G>A | N1303K |
| I507del | 3120+1G>A | R1162X |
| F508del | 3659delC | |
仅列出检测中包含的部分变异。如需查看TruSight Cystic Fibrosis 139-Variant Assay的完整变异列表,请访问wwwwww.illumina.com/ TruSightCysticFibrosis 。
TruSight Cystic Fibrosis性能
| TruSight Cystic Fibrosis 139-Variant Assay | |||
| 特征 | PAa | NAb | OAc |
| 准确度 | 100% | > 99.99% | > 99.99% |
| 重现性 | 99.77% | 99.88% | 99.88% |
| TruSight Cystic Fibrosis Clinical Sequencing Assay | |||
| 特征 | PAa | NAb | OAc |
| 准确度 | 99.66% | > 99.99% | > 99.99% |
| 重现性 | 99.22% | 99.70% | 99.70% |
a. 阳性一致性(PA)是指具有一致变异检出的样本数量除以参考方法鉴定出的具有该变异的样本总数。
b. 在所有野生型(WT)位点上计算阴性一致性(NA),方法是将一致的WT位点数量除以参考方法定义的WT位点总数。
c. 计算所有报告位置的总体一致性(OA),方法是将一致的野生型和变异位置的数量除以参考方法确定的报告位置总数。
TruSight Cystic Fibrosis Library Prep
20036925
支持TruSight Cystic Fibrosis 139-Variant Assay和TruSight Cystic Fibrosis Clinical Sequencing Assay。包括用于从96个外周全血样本中分离的基因组DNA的文库制备试剂。单独购买MiSeqDx测序试剂。
List Price:
Discounts:
MiSeq Dx Reagent Kit v3
20037124
包含一个流动槽和一个预装卡盒,其中包含簇生成试剂和测序试剂,可在MiSeqDx系统上支持一次样本文库运行。
List Price:
Discounts:
MiSeq™Dx Reagent Kit v3, Micro
20063860
包含一个微型流动槽和一个预装卡盒,内含簇生成试剂和测序试剂,在使用TruSight Cystic Fibrosis Library Prep时,可在MiSeqDx系统上支持24–36个制备好的文库。
List Price:
Discounts:
TruSeq Index Plate Fixture Kit (2 fixtures)
FC-130-1005
有助于正确地加入PCR扩增步骤的标签引物。内含两(2)个TruSeq Index Plate Fixture。
List Price:
Discounts:
TruSeq Index Plate Fixture & Collar Kit (2 each)
FC-130-1007
有助于正确地加入PCR扩增步骤的标签引物。内含两(2)个TruSeq Index Plate Fixture和两(2)个Plate Collar。
List Price:
Discounts:
显示 /
产品
数量
Unit Price
产品
货号
数量
单价
TruSight Cystic Fibrosis 139-Variant Assay可检测CFTR基因中的139个变异,用于携带者筛查、新生儿和儿童的确认性诊断检测以及初始诊断检测。
TruSight Cystic Fibrosis Clinical Sequencing Assay对CFTR基因的蛋白质编码区和内含子/外显子边界进行重新测序,有助于诊断、非典型表现的检测以及其他panel无法同时识别致病突变的情况。
是的,以稀释扩增子文库(DAL)形式储存的制备好的文库在冷冻储存时,可在制备后最多28天使用。制备用于TruSight Cystic Fibrosis 139-Variant Assay和TruSight Cystic Fibrosis Clinical Sequencing Assay的文库之间没有区别。
可以,当患者有非典型或非经典CF表现,或者其他突变panel未能识别两个致病突变时,您可以从TruSight Cystic Fibrosis 139-Variant Assay到TruSight Cystic Fibrosis Clinical Sequencing Assay进行反射检测。
两种TruSight Cystic Fibrosis检测均设计为使用MiSeqDx Reagent Kit v3运行。MiSeqDx v3测序流动槽已经过验证,每次测序运行可支持每次检测的24-96次检测。MiSeqDx Reagent Kit v3, Micro支持24-36个样本批次。 TruSight Cystic Fibrosis经过验证,每次流动槽运行至少支持24个样本。
参考文献:
1. CFTR的临床和功能翻译。https://www.cftr2.org。2013年8月访问。
2. Sosnay PR, Siklosi KR, Van Goor F, et al. 定义囊性纤维化跨膜传导调节因子基因中变异的疾病责任。Nature Genetics. 2013;45(10):1160-1167. doi:10.1038/ng.2745
3. Hughes EE, Stevens CF, Saavedra-Matiz CA, et al. 囊胞性纤维化突变panel在多种人群中的临床灵敏度。人类突变. 2016;37(2):201-208. doi:10.1002/humu.22927
4. Watson MS, Cutting GR, Desnick RJ, et al. 囊胞性纤维化群体携带者筛查:2004年美国医学遗传学会突变panel修订。Genet Med. 2004;6(5):387-391. doi:10.1097/01.gim.0000139506.11694.7c
5. Committee on Genetics. 美国妇产科医师学会委员会第486号意见:Update on carrier screening for cystic fibrosis. Obstet Gyncol. 2011;486:1-4. doi:https://pubmed.ncbi.nlm.nih.gov/21422883/
获取有关我们产品和服务的信息,或获得有关我们技术问题的答案。
Your email address is never shared with third parties.